2023年过半,我国创新药正处在去伪存真的发展阶段。
9月7日,CDE发布《中国新药注册临床试验进展年度报告(2022年)》。总体来看,2022年,药物临床试验登记与信息公示平台登记临床试验总量达3410余项,为历年登记总量最高,其中新药临床试验数量为1974项。
从药物临床试验数量可以窥见,创新药的春天并不抽象且绿意盎然。
另据Pharmaprojects® 2023年4月的数据显示,中国目前共有5402条药品管线,占全球管线数量的23.6%,比2022年的管线数量上涨23.22%,远超全球管线5.89%的增长。
随着管线数量增加,其中注册临床研究(以申报上市为目的的药物临床试验)占比也随之扩大,创新药企加速发展的决心可见一斑。再风光的药企面对创新药这一需要投入大量人力物力的行业,没有一条捷径可以走,甚至走到尽头都可能品尝失败的苦果。
医疗科研人员的日子同样不好过。研究任务与日常监查工作两座大山的压迫之下,“早7晚9已成为常态”,在日前举办的第十二届Medidata NEXT中国年会上,李进教授曾这样讲述临床研究人员面对的工作压力。
如何破局开发难度大、研发成本高昂、同质化竞争激烈的种种难点,更好地推动创新药的研发?扬帆出海的同时拥抱数字化,或将助力创新药企走向光明未来。
国产创新药的寒冬与春天
“出海热潮”带给创新药不少春天的希望。
一方面,IND数量近年来显著增加,国产创新药市场不再停留于单向输入的模式,以ADC为代表的国产创新药建立起大规模的生物技术基础设施及管线资产,研发进度频繁进入热门靶点全球研发前三,力求在license-out热潮中抢占一席之地。据不完全统计,今年1月-8月已有41个国产创新药项目成功出海。
政策护航下创新药企支付压力同样得以改善。
7月4日,国家医疗保障局发布《谈判药品续约规则(2023 年版征求意见稿)》《非独家药品竞价规则(征求意见稿)》意见,以临床价值为导向抬高准入门槛,自上而下为药企创新保驾护航。
然而不容乐观的另一方面,是资本寒冬迟迟不见暖意、科研动能衰竭已成为创新药企的共同困境。
从在研靶点来看,新兴靶点及适应症的市场空间虽令人神往,其研发难度同样令人望而生畏。即使是先天具有优势的First-in-class、Best-in-class类创新药,从源头创新也意味着面临周期更长难度更艰巨的研发过程,这无疑给一部分创新药企的决心蒙上了些许阴影。
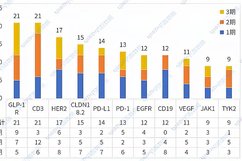
以ADC药物为例,受到最先被验证成功靶点的影响,很长时间里无数后来者扎堆 HER2\PD-1。国金证券此前公布的一份研报显示,国内ADC在研药物有超过60个是靶向HER2,位居首位;7月以来不少药企公布的靶向TROP2药物的临床试验结果也不尽如人意,直接导致了股价下跌或研究暂停。
根据最新排行,2022全球TOP30药企中仍然没有中国的公司,对此李进教授在今年中国创新药物(械)医学大会暨CMAC年会上一针见血地指出:根本原因就在于跨国公司忙创新,而中国公司忙内卷。
今年6月亿欧智库发布报告《2022年药品市场生命周期研究之GLP-1RA篇》中对此分析,随着临床管线逐步推向商业化,扎堆内卷热门靶点的大量Me-too类药物被市场淘汰成为必然,面对国谈背景下上市价格即“腰斩”的尴尬境地,缺乏商业化经验的Biotech企业将面临更加严峻的市场竞争和价格战。
报告同样指出,目前我国创新药商业化面临的困难主要有以下四点:其一,缺乏高质量的产能和稳定供应链;其二,缺乏上市后多样化的市场准入模式;其三,缺乏专业高效的销售推广及商业模式;其四,缺乏创新要上市后多层次支付体系。
国产PD-1出海频频遇挫,信达被拒、君实延期、百济失联的背后,是君实生物副总裁詹骁靖总结的“药物临床获益不明确、安全性数据存疑、缺乏国际多区域临床试验以及生产设施和记录存在问题”四点漏洞。
需要破局的不仅仅是赛道内卷及商业化的困局,苦苦挣扎在高投入、长周期临床试验中的药企们所渴望的新一轮转机,其到来的关键除了出海,还要结合数字化技术在临床领域的应用。
临床试验数字化推进进程
药物研发流程主要包括药物发现、临床前研究以及临床试验三个阶段。
数据采集作为药物研发的坚实地基,也是数字化的第一步。
早在20多年前Medidata就推出了Rave EDC。作为最早的电子数据采集工具之一,也是最早支持临床数字化的产品,截至目前Medidata在全球范围内已支持超过 30000 个临床研究,入组患者逾 900 万。在与东方临床肿瘤研究中心的合作中,Rave也充分保障了临床研究的合规性以及数据质量的可靠性。
目前,Medidata AI已经能够通过追溯试验中心过去或者现行试验的患者保留率以及运营表现等历史数据,为企业快速地定位到合适的试验中心并促进患者入组,从而缩短项目交付时间,减少受试者脱落。
而成功率仅10%的临床试验是相对高监管且高风险的产业,其研发费用在整个周期中占比约80%,如何提高研发效率避免研究失败?许多生物制药公司已经率先开始探索人工智能算法与临床试验全过程的有机结合。
例如此前与辉瑞达成合作的Iterative Scopes,就是通过AI视觉分析,在IBD临床试验中帮助医生指定患者招募计划,并通过整合数据加快临床研究进程。
有效探索案例还有2020年获得FDA批准,用于美国临床阶段免疫治疗公司Medicenna Therapeutics 公司MDNA55治疗复发性胶质母细胞瘤(rGBM) III 期注册试验中的Medidata AI Synthetic Control Arm®(SCA)合成对照组解决方案。在此试验中,Medidata成功帮助Medicenna在此三期临床中减少招募了100个对照患者,这也成为了罕见病试验采用混合外部对照组的首创之举。
数字化在患者监测、治疗以及安全保障方面同样发挥了重要作用。
过去在临床试验中,需要耗费大量人力、时间记录患者信息,例如药物摄入、身体功能以及对于药物反应的记录,以及各项数据检查等,而医生的数量远赶不上在研管线扩张的速度。如何能够为医生减负的同时又把研究任务完成呢?近年来Medidata推进的Medidata AI就是一个正面教材。
Medidata AI主要有四个高光点:Trial Design,Study Feasibility, Performance Analytics和SCA合成对照组。
首先,利用Trial Design 设计出以患者为中心的高效运营试验,采用量化指标衡量研究项目复杂程度、研究中心工作量、患者负担和成本,进而降低患者招募和保留率低下的风险,从而实现研究需求和运营效率的平衡。
随后,Study Feasibility依据来自历史临床试验的绩效指标,和研究项目、国家/地区和研究机构级别及相关研究者细致划分提供的研究机构排名和拥塞指标,快速选定研究国家和机构,并通过 Performance Analytics进行绩效评估和方案更正。
而SCA合成对照组的应用则集中在帮助申办方比较新疗法和标准治疗下不同的患者结局,以期加强单臂II期试验、加速审批递交和某些适应症下的III期试验。
保证患者安全作为整个临床试验的重中之重,推动每一项新技术之前都需要多方验证。已知目前四款纳入医保的PD-1药物和首个FDA获批上市的国产创新药泽布替尼,其研发过程都借力于Medidata技术的支持。以Medidata为代表的一众临床数据管理系统研发公司,正在引领国内生命科学领域数字化转型的全过程。
对于国产创新药的未来,李进教授曾在今年第十二届Medidata NEXT中国年会上大胆期待一个崭新春天的到来。毋庸置疑,以国家和政府的强劲支持为加速器,在人口老龄化及慢性病患者日益增加的市场激励下加速提升研发能力,积跬步以走千里、集小流汇成大海,中国创新药企定将大有可为。
扬帆出海、以数智创新加快药研新时代到来,不仅是激烈竞争下创新药企必经的转型之路,也是人工智能驱动临床试验适应人类文明发展需要的必然。
通过数字化改善临床试验设计,提升患者入组成功率,推动试验效率,并优化试验洞察,将加快生命科学的数智变革、助力更多医药创新成果造福患者。
 微信扫一扫打赏
微信扫一扫打赏
 支付宝扫一扫打赏
支付宝扫一扫打赏